检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
蛋白质激酶AMPK和mTOR是细胞内代谢调控的关键分子1。mTORC1是mTOR形成的复合体之一(另一个是mTORC2),在营养物质充分时——包括在富含生长因子、氨基酸和葡萄糖等条件下(如饱食后),它能够被激活,进而促进一系列合成代谢相关途径的活化,使细胞开始合成蛋白质、脂质和核苷酸等“building blocks”,并可抑制自噬作用,促进营养物质的储存2。mTORC1的这一功能对于细胞增殖也是必需的:不论是在机体发育过程中,还是在肿瘤中,都常能观察到mTORC1的高活力,它也因此成为抗肿瘤药物筛选的重要靶点之一3。
正是因为mTORC1的重要性,关于它如何被上述营养物质所调控的研究也就成为了相关领域的前沿问题。目前已经发现,mTORC1是在溶酶体上被激活的。而两类定位在溶酶体表面的小G蛋白Rheb和RAGs的活化,是mTORC1激活的关键4,5。目前的研究发现,生长因子能够通过PI3K-AKT-TSC1/2途径,通过活化Rheb,后者进一步结合mTORC1来促进其激活6。而不同的氨基酸既可以通过各自的受体,活化RAGs,促进mTORC1向溶酶体的迁移来激活mTORC17,也可以直接通过相对应的氨酰tRNA合成酶,对RAGs进行相应的修饰(如Leu-tRNA可以通过LARS,亮氨酰化修饰RAGA),从而激活mTORC18。此外,在氨基酸水平上升时,RAG抑制分子如GATOR1能被降解,从而引起RAGs的激活9。最近的研究还表明,来自于胞外的蛋白质可以被降解成相应的氨基酸,再通过GATOR1、RAGs激活mTORC110。相比较之下,葡萄糖对mTORC1调节的研究则远不如前两者充分。普遍的观点认为,葡萄糖能通过AMPK调节mTORC1(如葡萄糖水平下降,则激活AMPK来抑制mTORC1)11,但后续的研究表明即使没有AMPK,葡萄糖仍能调控mTORC1,说明了葡萄糖自身存在着调节mTORC1的独立机制。2009年,韩国浦项科技大学的S.H.Ryu课题组率先报道了糖酵解途径的代谢酶甘油醛-3-磷酸脱氢酶(GAPDH)能够感受葡萄糖的代谢产物甘油醛-3-磷酸(G3P)的水平,并在G3P水平上升时,离开Rheb,从而解除其对Rheb的抑制而激活mTORC112。后续的研究又陆续报道了PFK1、HK2等糖酵解代谢酶可以直接结合mTORC1调节其活力13,14。2012年,MIT的Sabatini课题组报道了在持续性激活的RAGA敲入小鼠中,mTORC1维持高活力并不受葡萄糖水平的调控,证明了RAGs也是葡萄糖调控mTORC1所必需,甚至是占有主导地位的15。但长久以来,葡萄糖如何被感受并经由RAGs调节mTORC1一直未知。
最近,林圣彩教授课题组发表在Cell Research上的文章正是报道了这一过程16。他们课题组先前发现了饥饿时,葡萄糖能够通过其代谢产物1,6-二磷酸果糖(FBP)水平的下降,再通过FBP空置的醛缩酶作为感受器,抑制阳离子(钙)通道TRPV,进而抑制v-ATPase和Ragulator,从而激活AMPK的过程17-19。

鉴于在氨基酸调控mTORC1的过程中,v-ATPase也能够通过调节Ragulator-RAGs进而调节mTORC1,于是他们尝试探究葡萄糖是否也通过醛缩酶,被感知并介导mTORC1的调节。然而由于醛缩酶本身就是维持v-ATPase活力所必需20,21,他们发现敲低醛缩酶直接就引起了mTORC1的抑制,这为鉴定醛缩酶的葡萄糖感知对mTORC1活力调节作用带来了很大的麻烦。为了解决这个问题,他们采用了醛缩酶的两个突变体:D34S和K230A——前者能够结合FBP但不能催化,代表了高糖情况下有FBP结合的醛缩酶;后者则不能结合FBP,代表了低糖时的醛缩酶——来模拟高糖和低糖下醛缩酶的状态22,23。他们还进一步通过蛋白质谱的方式,直接鉴定了两个突变体上不同水平的“FBP化”修饰,从而确定了两个突变体的准确性。用这两个突变体,林圣彩课题组成功验证了醛缩酶能够通过结合FBP从而调节mTORC1的结论,也证明了醛缩酶就是Ragulator-RAGs这一途径里的葡萄糖感受器。从这里我们可以看到,要准确地鉴定一个感受器并不是一件容易的事情,特别是很多感受器本身可能具有除感知代谢物之外的其它功能,因此“简单粗暴”地敲除一个蛋白并不足以证明该问题,最好的办法还是尝试去还原其结合/不结合代谢物的本真状态。
在本文的其它部分,他们还验证了TRPV作为醛缩酶的下游,承接了醛缩酶传递的信号调节mTORC1的结论,并梳理了该条通路独立于AMPK行使葡萄糖感知调节mTORC1的关系,又一次指出葡萄糖水平的下降本身的作用——此时是能通过醛缩酶直接抑制mTORC1。于是,醛缩酶在此行使了承接葡萄糖水平,同时调控AMPK和mTORC1两大下游的“rheostat”的作用,成为了维持机体健康长寿的“晴雨表”。
除了揭示了葡萄糖通过RAGs调节mTORC1的机制以外,这篇文章又一次“加码”了本就已经十分复杂的mTORC1调节领域,也给我们带来了很多新的思考:
首先,除了AMPK,醛缩酶并不是第一个被报道的,能够响应葡萄糖调节mTORC1的分子:如上所述,Rheb能够被GAPDH——通过其结合/不结合G3P的形式所调节12,因此这些已知的葡萄糖感受器如何相互协调就是未来的一个主要的研究方向了。在本文中,作者们猜测,Rheb和RAGs可能在发挥了互补的作用,比如大部分的细胞中,RAGs对mTORC1的调节是主导的,但已有证据表明,敲除RAGs,Rheb仍能发挥调控mTORC1的作用24,25,因此葡萄糖对mTORC1的调控是多层次的(图1)。有意思的是,还有研究表明,氨基酸和生长因子对mTORC1的调节也不是严格地分别经由RAG和Rheb进行的:氨基酸可以通过Rheb26-28,生长因子也可以调节RAGs29,因此机体很可能通过这种“条条大路通罗马”的方式保证了一个重要过程的准确调节。
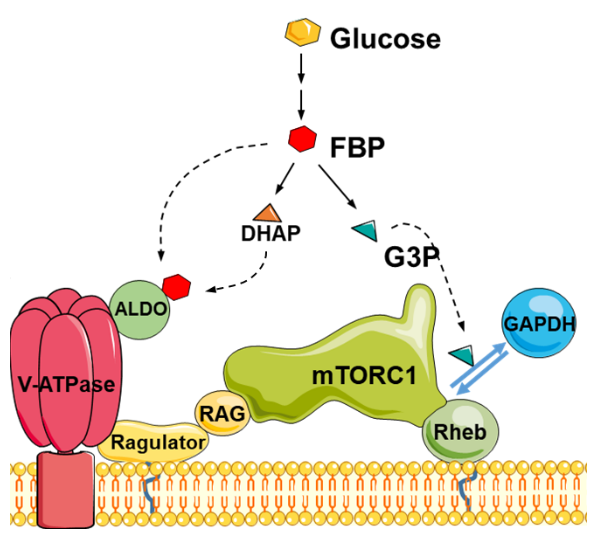
图1 葡萄糖通过其代谢产物多层次地调节mTORC1
其次,作者们还意外地发现,高糖状态下的醛缩酶除了能被“FBP化”以外,还有相当的比例能够被它的另一个底物DHAP所结合,这说明了一个感受器很可能不止感知一种代谢产物。有意思的是,前不久Sabatini课题组发表在Nature Metabolism上的文章也指出,DHAP是调节mTORC1的一个重要的代谢物30,尽管他们并未证明哪一个蛋白是DHAP的感受器,而且实验体系也有一定问题:敲除醛缩酶后的mTORC1已被“组成型”地失活,因而他们只观察到DHAP对mTORC1活力的“微小”变化,更不必说这一变化可能来源于GAPDH对Rheb的互补调节12。但仅就目前看来,醛缩酶很可能具有同时感受DHAP和FBP来调节mTORC1的能力。
顺便一提,Sabatini小组也曾尝试去研究葡萄糖是否通过已确定在氨基酸感知中起重要作用的GATOR1来感知葡萄糖,以达到调节mTORC1的活力。他们发现敲除GATOR1之后,葡萄糖饥饿不再抑制mTORC1。但该实验仍无法证明葡萄糖确实通过GATOR1调节mTORC1,因为敲除了GATOR1,mTORC1呈现组成型激活,不仅是葡萄糖,包括氨基酸在内的任何营养物质都不再能调节mTORC1了31。故此,葡萄糖和氨基酸的信号是否能、以及如何被协调从而调节mTORC1,还等待着我们继续去探索。
原文链接:https://www.nature.com/articles/s41422-020-00456-8
参考文献
1 Gonzalez, A., Hall, M. N., Lin, S. C. & Hardie, D. G. AMPK and TOR: The Yin and Yang of Cellular Nutrient Sensing and Growth Control.Cell metabolism31, 472-492, doi:10.1016/j.cmet.2020.01.015 (2020).
2 Saxton, R. A. & Sabatini, D. M. mTOR Signaling in Growth, Metabolism, and Disease.Cell168, 960-976, doi:10.1016/j.cell.2017.02.004 (2017).
3 Guri, Y. & Hall, M. N. mTOR Signaling Confers Resistance to Targeted Cancer Drugs.Trends in cancer2, 688-697, doi:10.1016/j.trecan.2016.10.006 (2016).
4 Stocker, H.et al.Rheb is an essential regulator of S6K in controlling cell growth in Drosophila.Nature cell biology5, 559-565, doi:10.1038/ncb995 (2003).
5 Sancak, Y.et al.The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1.Science320, 1496-1501, doi:10.1126/science.1157535 (2008).
6 Inoki, K., Li, Y., Zhu, T., Wu, J. & Guan, K.-L. TSC2 is phosphorylated and inhibited by Akt and suppresses mTOR signalling.Nature cell biology4, 648-657, doi:10.1038/ncb839 (2002).
7 Wolfson, R. L. & Sabatini, D. M. The Dawn of the Age of Amino Acid Sensors for the mTORC1 Pathway.Cell metabolism26, 301-309, doi:10.1016/j.cmet.2017.07.001 (2017).
8 He, X. D.et al.Sensing and Transmitting Intracellular Amino Acid Signals through Reversible Lysine Aminoacylations.Cell metabolism27, 151-166 e156, doi:10.1016/j.cmet.2017.10.015 (2018).
9 Chen, J.et al.KLHL22 activates amino-acid-dependent mTORC1 signalling to promote tumorigenesis and ageing.Nature557, 585-589, doi:10.1038/s41586-018-0128-9 (2018).
10 Hesketh, G. G.et al.The GATOR-Rag GTPase pathway inhibits mTORC1 activation by lysosome-derived amino acids.Science370, 351-356, doi:10.1126/science.aaz0863 (2020).
11 Inoki, K., Zhu, T. & Guan, K. L. TSC2 mediates cellular energy response to control cell growth and survival.Cell115, 577-590 (2003).
12 Lee, M. N.et al.Glycolytic flux signals to mTOR through glyceraldehyde-3-phosphate dehydrogenase-mediated regulation of Rheb.Molecular and cellular biology29, 3991-4001, doi:10.1128/MCB.00165-09 (2009).
13 Almacellas, E.et al.Phosphofructokinases Axis Controls Glucose-Dependent mTORC1 Activation Driven by E2F1.iScience20, 434-448, doi:10.1016/j.isci.2019.09.040 (2019).
14 Roberts, D. J., Tan-Sah, V. P., Ding, E. Y., Smith, J. M. & Miyamoto, S. Hexokinase-II positively regulates glucose starvation-induced autophagy through TORC1 inhibition.Molecular cell53, 521-533, doi:10.1016/j.molcel.2013.12.019 (2014).
15 Efeyan, A.et al.Regulation of mTORC1 by the Rag GTPases is necessary for neonatal autophagy and survival.Nature493, 679-683, doi:10.1038/nature11745 (2013).
16 Li, M.et al.Aldolase is a sensor for both low and high glucose, linking to AMPK and mTORC1.Cell Res, doi:10.1038/s41422-020-00456-8 (2020).
17 Zhang, C. S.et al.The lysosomal v-ATPase-Ragulator complex Is a common activator for AMPK and mTORC1, acting as a switch between catabolism and anabolism.Cell Metab.20, 526-540, doi:10.1016/j.cmet.2014.06.014 (2014).
18 Zhang, C. S.et al.Fructose-1,6-bisphosphate and aldolase mediate glucose sensing by AMPK.Nature548, 112-116, doi:10.1038/nature23275 (2017).
19 Li, M.et al.Transient Receptor Potential V Channels Are Essential for Glucose Sensing by Aldolase and AMPK.Cell metabolism30, 508-524 e512, doi:10.1016/j.cmet.2019.05.018 (2019).
20 Lu, M., Sautin, Y. Y., Holliday, L. S. & Gluck, S. L. The glycolytic enzyme aldolase mediates assembly, expression, and activity of vacuolar H+-ATPase.The Journal of biological chemistry279, 8732-8739, doi:10.1074/jbc.M303871200 (2004).
21 Lu, M., Ammar, D., Ives, H., Albrecht, F. & Gluck, S. L. Physical interaction between aldolase and vacuolar H+-ATPase is essential for the assembly and activity of the proton pump.The Journal of biological chemistry282, 24495-24503, doi:10.1074/jbc.M702598200 (2007).
22 Morris, A. J. & Tolan, D. R. Site-directed mutagenesis identifies aspartate 33 as a previously unidentified critical residue in the catalytic mechanism of rabbit aldolase A.J. Biol. Chem.268, 1095-1100 (1993).
23 Choi, K. H., Shi, J., Hopkins, C. E., Tolan, D. R. & Allen, K. N. Snapshots of catalysis: the structure of fructose-1,6-(bis)phosphate aldolase covalently bound to the substrate dihydroxyacetone phosphate.Biochemistry40, 13868-13875, doi:10.1021/bi0114877 (2001).
24 Demetriades, C., Doumpas, N. & Teleman, A. A. Regulation of TORC1 in response to amino acid starvation via lysosomal recruitment of TSC2.Cell156, 786-799, doi:10.1016/j.cell.2014.01.024 (2014).
25 Thomas, J. D.et al.Rab1A is an mTORC1 activator and a colorectal oncogene.Cancer Cell26, 754-769, doi:10.1016/j.ccell.2014.09.008 (2014).
26 Gao, X.et al.Tsc tumour suppressor proteins antagonize amino-acid-TOR signalling.Nature cell biology4, 699-704, doi:10.1038/ncb847 (2002).
27 Fawal, M. A., Brandt, M. & Djouder, N. MCRS1 binds and couples Rheb to amino acid-dependent mTORC1 activation.Developmental cell33, 67-81, doi:10.1016/j.devcel.2015.02.010 (2015).
28 Carroll, B.et al.Control of TSC2-Rheb signaling axis by arginine regulates mTORC1 activity.Elife5, doi:10.7554/eLife.11058 (2016).
29 Yang, S.et al.The Rag GTPase Regulates the Dynamic Behavior of TSC Downstream of Both Amino Acid and Growth Factor Restriction.Developmental cell55, 272-288 e275, doi:10.1016/j.devcel.2020.08.006 (2020).
30 Orozco, J. M.et al.Dihydroxyacetone phosphate signals glucose availability to mTORC1.Nat Metab2, 893-901, doi:10.1038/s42255-020-0250-5 (2020).
31 Bar-Peled, L.et al.A Tumor suppressor complex with GAP activity for the Rag GTPases that signal amino acid sufficiency to mTORC1.Science (New York, N.Y.)340, 1100-1106, doi:10.1126/science.1232044 (2013).
(文/图 林圣彩课题组)