检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
5月15日,袁晶课题组在TheEMBO Journal杂志上发表题为A Protein Palmitoylation Cascade Regulates Microtubule Cytoskeleton Integrity inPlasmoidum的研究论文。该研究揭示了疟原虫在按蚊寄生传播中的膜下微管骨架介导合子-动合子细胞极性变形的分子细胞机制。

疟原虫是寄生性原生动物类病原,每年导致数亿人口感染疟疾和数十万人死亡。疟疾的传播必须通过雌性按蚊。疟疾病人或者动物被按蚊叮咬吸血后,疟原虫伴随血液作为“食物”进入按蚊消化道中肠。为了避免被消化酶分解,疟原虫进化出复杂而高效的感染、寄生和传播的适应性机制。在中肠肠腔内,疟原虫雌雄配子受精,形成圆形的合子Zygote(受精卵),合子需要变形转化成新月形的动合子Ookinete,只有动合子才能穿越中肠上皮,定植在中肠基底(体腔)侧,建立按蚊感染。合子-动合子的细胞变形,包括极性突出-极性延伸-成熟,是一个微管重组建立膜下细胞骨架和细胞极性的过程。
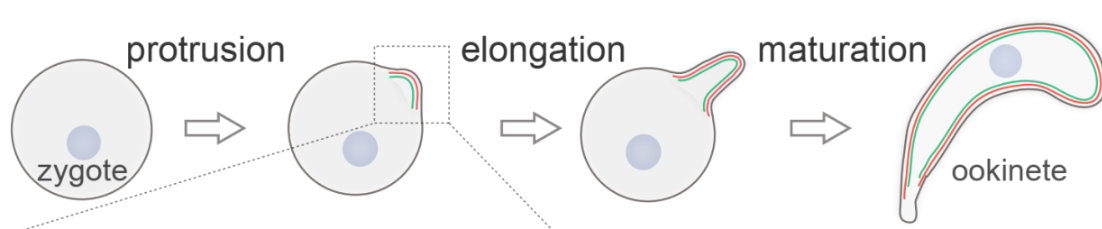
前人工作已经揭示,动合子较之合子,在细胞突出和延伸部分,紧贴细胞质膜(PPM)内侧新形成了内膜复合物(Inner Membrane Complex, IMC)和膜下微管(Subpellicular microtubule, SPM)结构,构成具有高度规则的穹顶状的微管骨架。IMC和SPM共同构成膜下细胞骨架,支撑细胞变形。然而,IMC和SPM如何建立稳固连接;SPM的60根微管如何在细胞顶端建立高度规则的穹顶状排布,这些问题至今没有答案。
作者之前工作(Current Biology,2018)发现ISP1单敲除后疟原虫动合子转化减少,提示ISP蛋白参与调控合子-动合子变形。在本工作中,发现ISP1/ISP3双基因敲除导致合子-动合子转化显著下降,并且动合子转化停滞在细胞变形的早期;与此一致,双基因敲除虫株血饲按蚊后,疟原虫感染和传播显著减少。有意思的是,ISP1和ISP3蛋白在合子细胞极性共定位,在细胞变形过程中一直在细胞突出和延伸部分的IMC定位。ISP1/ISP3蛋白均没有跨膜结构和信号肽,如何实现IMC的特定定位呢?作者发现ISP1/ISP3蛋白存在棕榈酰化修饰;并且ISP1/ISP3蛋白氨基端半胱氨酸的棕榈酰化修饰,直接决定了ISP1/ISP3蛋白的IMC定位和蛋白功能。
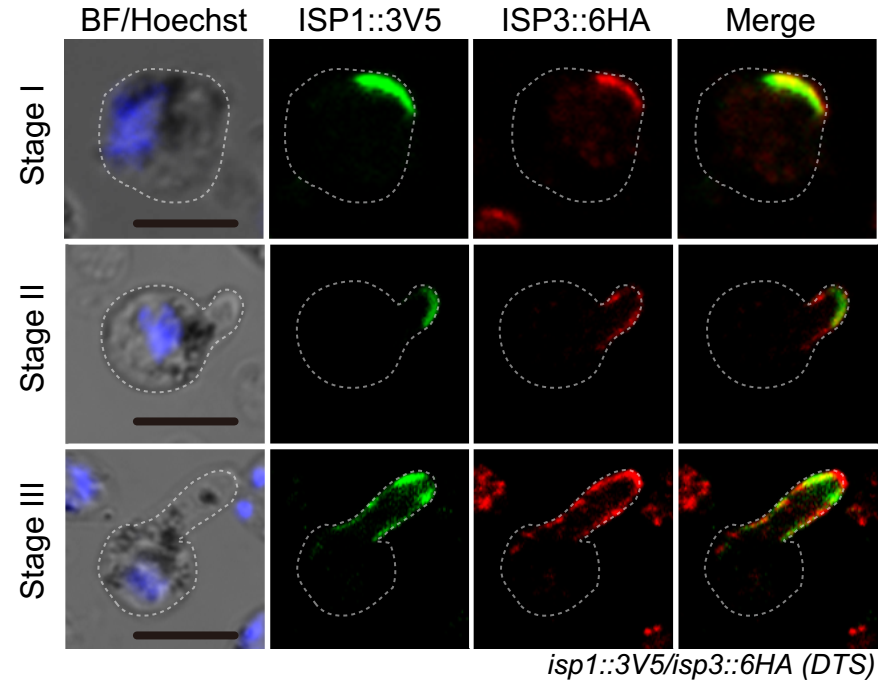
为了寻找催化ISP1/ISP3的上游棕榈酰转移酶PAT,通过筛选发现棕榈酰转移酶DHHC2也极性定位在动合子IMC,在细胞变形过程中和ISP1/ISP3共定位。敲低DHHC2导致ISP1/ISP3棕榈酰化丢失,蛋白失去IMC定位;同时,合子-动合子变形完全停滞在早期,与ISP1/ISP3双基因敲除表型一致。由此,确定了DHHC2-ISP1/ISP3的酶-底物关系。那么,DHHC2的IMC定位又是如何调控的?作者发现DHHC2蛋白羧基端多个半胱氨酸残基高度保守,并且被DHHC2自身棕榈酰转移酶活性催化。DHHC2自身棕榈酰化修饰调控蛋白定位到受精后合子细胞中新合成的IMC上。
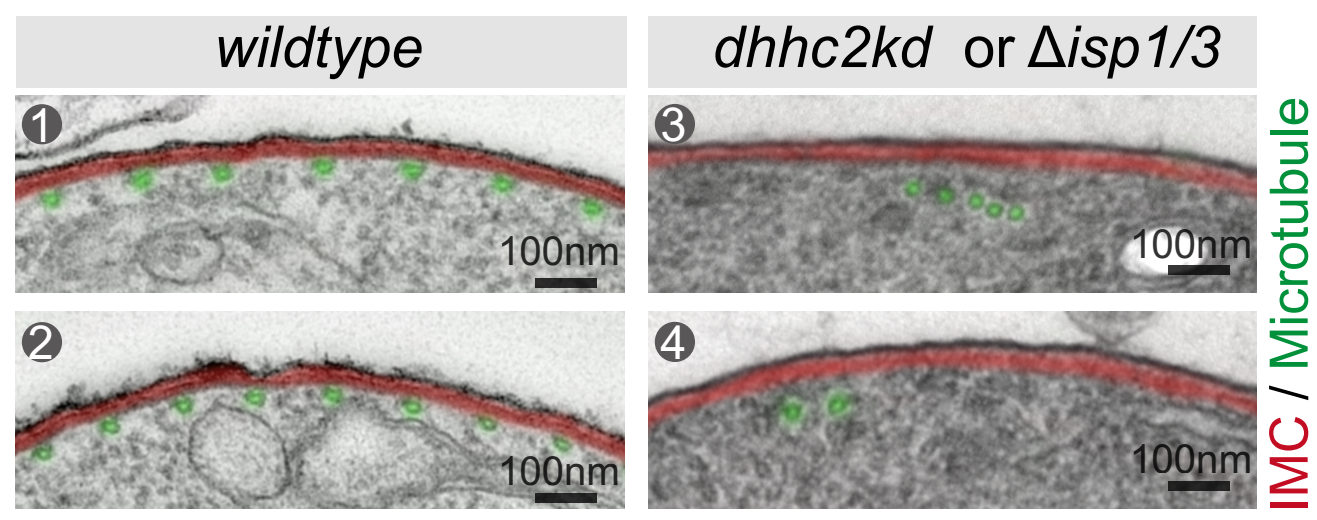
细胞超微结构显示,ISP1/ISP3缺失或DHHC2敲低后,SPM微管不再附着于IMC;同时,60根微管构成的穹顶状骨架结构紊乱。机制上,ISP1/ISP3蛋白的N端通过半胱氨酸棕榈酰化锚定IMC,C端的PH结构域与SPM微管的β-Tubulin互作,充当连接IMC和SPM的桥梁分子。ISP1/ISP3-Tubulin的物理连接,保证了从动合子顶端生长的60根微管,紧密附着住IMC,形成具有高度规则的穹顶状微管骨架,支持合子-动合子的极性延伸。
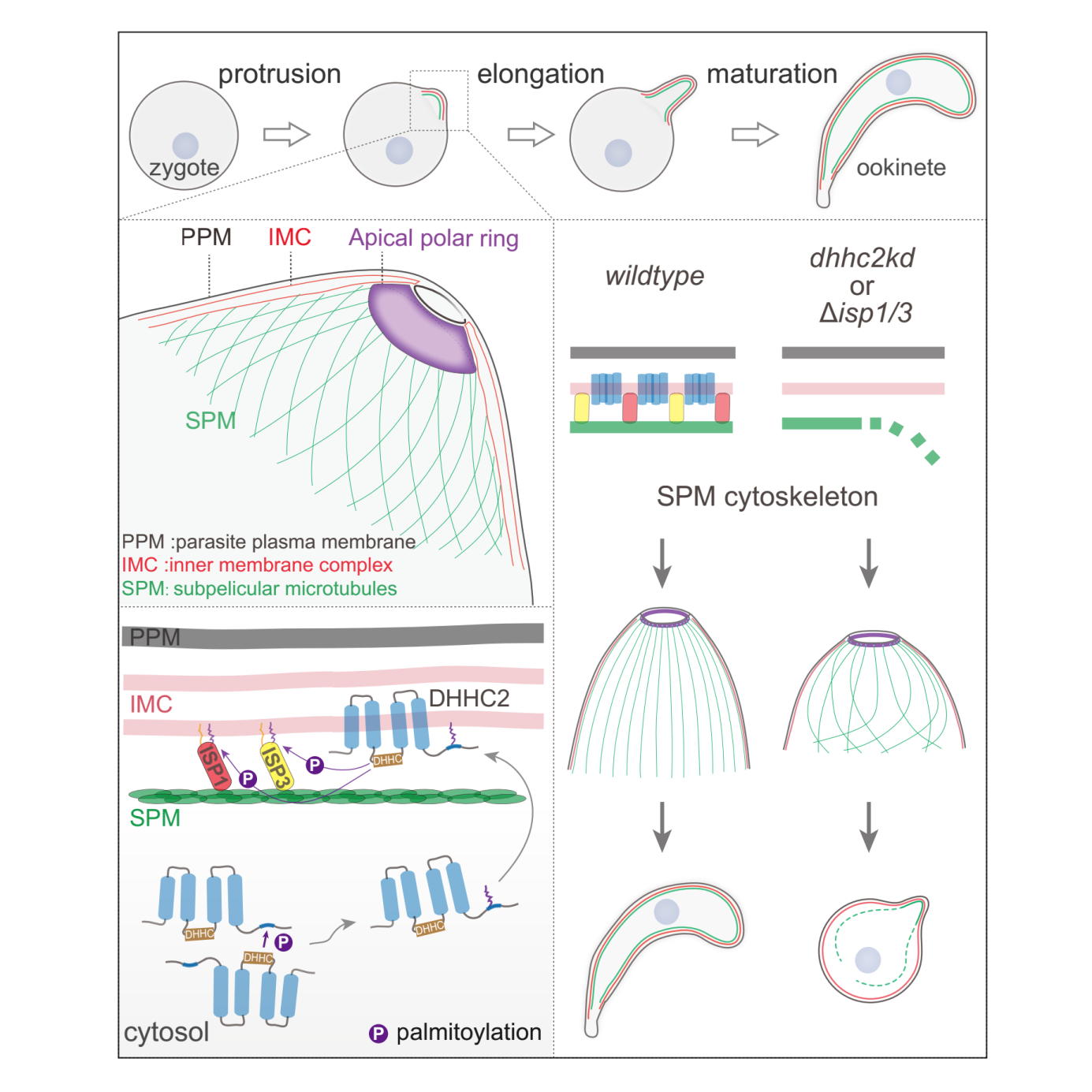
这个工作发现了蛋白棕榈酰化修饰精准调控疟原虫膜下微管骨架和细胞变形,也揭示了膜细胞器和非膜细胞结构之间物理连接的一种独特机制。
伟德国际官网登录入口博士生王旭和钱鹏戈为本文第一作者;仪器平台姚路明博士提供了电镜支持;袁晶教授为本文通讯作者,伟德国际官网登录入口为第一完成单位。该研究得到国家自然科学基金和伟德国际官网登录入口校长基金资助。
论文全文链接:https://www.embopress.org/doi/full/10.15252/embj.2019104168
(伟德BETVlCTOR1946)