检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox

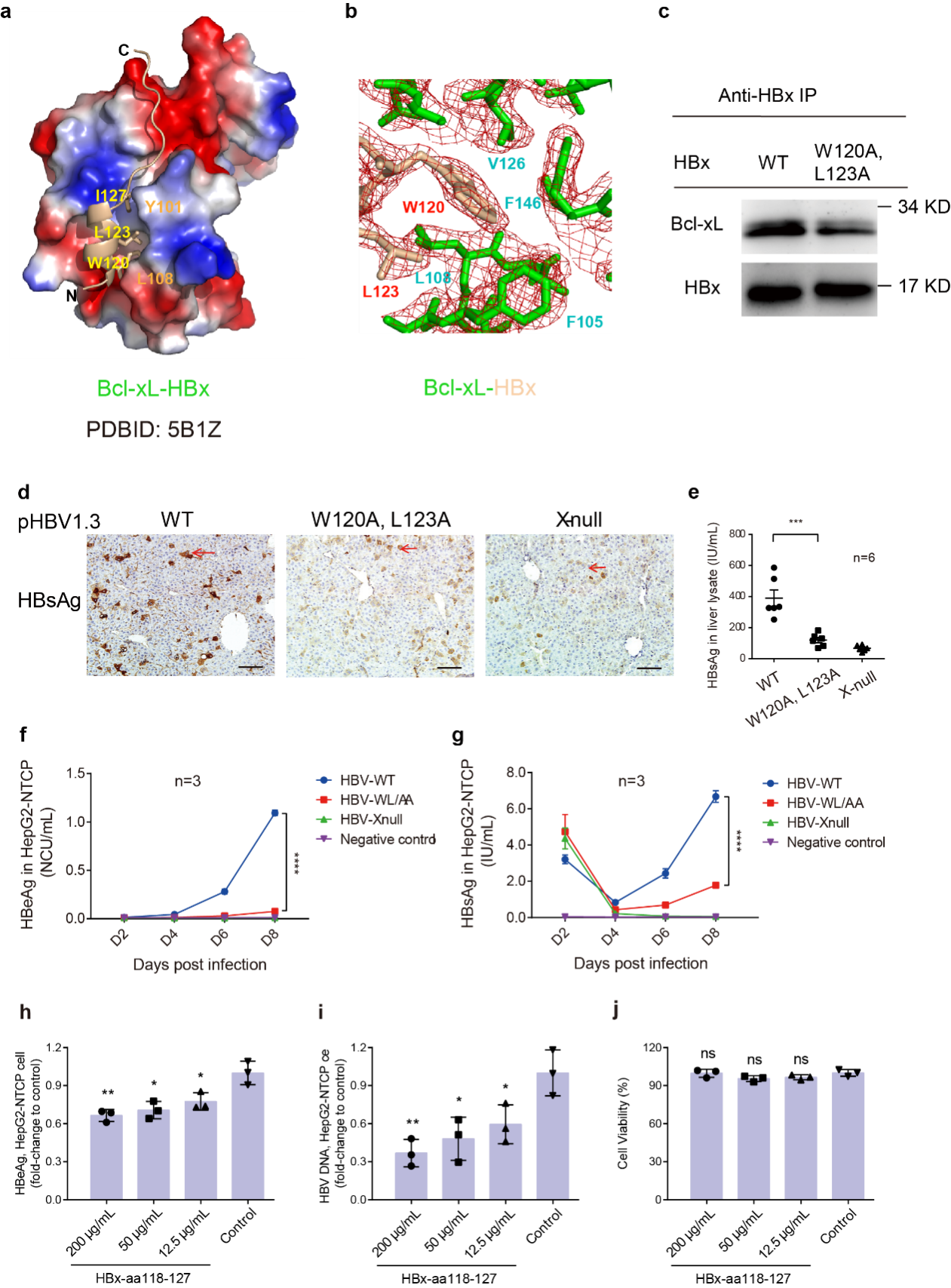
7月19日,Nature Communications期刊刊出了我院夏宁邵教授团队发表的题为“Structural and functional analyses of hepatitis B virus X protein BH3-like domain and Bcl-xL interaction”的研究论文。该论文解析了乙肝病毒(HBV)X蛋白(HBx)BH3-like基序与宿主抗凋亡蛋白Bcl-xL的复合物晶体结构,在体内外模型中证实了该基序对HBV复制的重要性;基于此发现设计的短肽HBx-aa118-127可抑制HBV。该研究为靶向HBx的抗HBV新药设计提供了结构和功能方面的创新见解。
HBx是HBV的一个具有多维功能的非结构蛋白,在HBV的感染、复制和致癌过程中起重要作用。夏宁邵教授团队与美国科罗拉多大学薛定教授课题组曾合作发现HBx BH3-like基序与抗凋亡蛋白Bcl-2和Bcl-xL能直接相互作用,介导细胞内钙离子浓度上调,促进HBV复制并引起细胞凋亡(PNAS 2012)。但此前研究尚不清楚这一相互作用的结构基础。在此次研究中,该团队与美国科罗拉多大学薛定教授课题组、新加坡国立大学Adam Yuan教授课题组开展合作,解析了HBx BH3-like多肽与Bcl-xL的复合物晶体结构(分辨率为2.15Å),发现HBx BH3-like基序形成一个短的α-螺旋并通过Trp120残基和保守的Leu123残基结合至Bcl-xL的疏水口袋中。该疏水口袋与经典的抗凋亡蛋白BH3-only基序结合口袋相距约2Å。Trp120和Leu123的双突变可导致HBx与Bcl-xL的结合能力变弱,进而降低HBV复制水平;基于HBV转染、感染细胞模型和尾静脉高压注射小鼠模型,在多肽、HBx全长表达克隆和HBV复制子三个层面上,验证了Trp120和Leu123所在的基序对于HBV复制的重要性。进一步的功能研究表明,晶体培养中所使用的HBx BH3-like多肽HBx-aa113-135可部分回补HBx缺失的HBV病毒株的复制能力,而较短的多肽HBx-aa118-127可在体外感染模型中抑制HBV的复制。
总之,该研究通过对HBx BH3-like结构域/Bcl-xL的复合物晶体结构解析和功能验证,揭示了HBx影响HBV复制和转录的分子机制,有助于指导靶向该位点的抗HBV新药开发。
我校张天英博士、新加坡国立大学陈红英女士、我校曹佳莉博士生为该论文共同第一作者,夏宁邵教授、薛定教授、袁权副教授为该论文的共同通讯作者。该研究获得了“艾滋病和病毒性肝炎等重大传染病防治”国家科技重大专项、新加坡国家科学基金、国家自然科学基金、中国博士后科学基金、福建省杰出青年科学基金等项目资助。
论文链接:https://www.nature.com/articles/s41467-019-11173-1
(伟德BETVlCTOR1946)