检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
机体有着一系列精妙的机制来感知糖、脂类和氨基酸等营养物质的水平,并做出反应以维持物质和能量代谢的稳态;若感应机制失效,则可能导致代谢性疾病的发生。这些过程不但是生物学的一个核心问题,也与我们的生活密切相关。葡萄糖是生物体最基本的物质和能量的来源,其水平升高会引起胰岛素的分泌,进一步引起包括脂肪合成在内的合成代谢途径的上调,从而加速机体对这些营养物质的同化,而其水平的下降则会引起一系列分解代谢途径的上调,产生能量以供应机体所需。因此,对葡萄糖水平的感应是我们在应对如饥饿等应激状态下的生理功能所必需的。
近年来,林圣彩教授课题组在葡萄糖感知及其对代谢稳态的维持,特别是在对葡萄糖水平的下降并进一步激活代谢的核心调控者AMPK(AMP-activated protein kinase)从而调节下游的代谢通路的机制上,取得了一系列重大进展。2013年,他们发现AXIN蛋白是将上游激酶LKB1带到AMPK并激活它的桥梁(Cell Metabolism,2013)。 2014年,他们的文章解析了,在葡萄糖水平下降时,AMPK和LKB1通过AXIN蛋白结合到溶酶体膜上v-ATPase复合物和Ragulator所在区域,AMPK在此被LKB1激活,启动下游分解途径(Cell Metabolism,2014)。于此同时,v-ATPase失活,mTOC1复合体离开了溶酶体,合成途径关闭(Cell Metabolism,2014)。2017年,他们进一步的研究揭示了在葡萄糖匮乏情况下,1,6二磷酸果糖(FBP)水平降低,FBP醛缩酶(adolase)被解除抑制。醛缩酶促进v-ATPase, Ragulator和AMPK-AXIN-LKB1之间的动态组合,形成超级复合体,并激活了AMPK;从而初步描绘了葡萄糖感知和AMPK调控的“路线图”(Nature ,2017)。 2019年4月,Cell Research又以封面文章报道林圣彩课题组的最新研究成果:不同程度的能量缺乏可逐级激活胞内不同区域的AMPK,展示了AMPK的时空调控全图(Cell Research,2019)。但在上述葡萄糖感知的画卷中有一个尚未解决的问题是未结合FBP的醛缩酶如何抑制v-ATPase的活性,促成了超级复合体形成从而激活溶酶体上的AMPK。
2019年6月13日, Cell Metabolism杂志在线发表了林圣彩教授的最新成果:Transient Receptor Potential V Channels Are Essential for Glucose Sensing by Aldolase and AMPK,发现阳离子通道蛋白TRPV介导葡萄糖感知到AMPK激活的过程的作用和机制,为葡萄糖感知和AMPK激活的“路线图”添上了重要的一笔,可视为让葡萄糖感知通路全线贯通的重要一环。

该工作是在该课题组2017年发现的基础上的进一步延伸。首先他们通过质谱分析鉴定出了阳离子通道家族TRPV可与醛缩酶蛋白结合;这一结合可被生理浓度的FBP所抑制。他们还观察到在葡萄糖水平降低的情况下,FBP的浓度也随之降低,TRPV的钙离子通道活性被抑制。其后,他们发现无论是通过小分子抑制剂抑制TRPV通道活性还是钙离子螯合剂降低胞内钙离子水平,均可以阻碍溶酶体酸化,提示了v-ATPase活性受到了影响。在加入钙离子螯合剂时即使葡萄糖水平正常,AXIN蛋白也定位于溶酶体,AMPK可被磷酸化。进一步的工作表明,TRPV位于内质网和溶酶体接触的区域;葡萄糖水平下降可造成内质网-溶酶体附近胞内区域钙离子浓度的降低。最后他们的工作证明了未结合FBP的醛缩酶可结合TRPV并抑制其钙离子的通道活性;钙离子浓度下降促使了醛缩酶-v-ATPase复合体的变构,从而抑制v-ATPase,最终启动溶酶体上的AMPK激活途径,引起此处AMPK的活化(下图)。
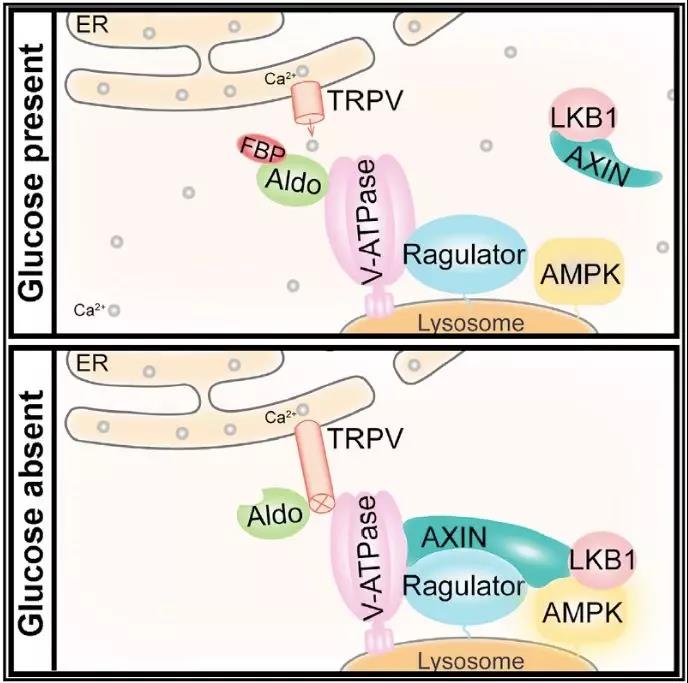
这一工作不仅精巧地分析了不同葡萄糖浓度下内质网-溶酶体接触附近的多个蛋白复合体的动态变化,补全了葡萄糖信号从FBP水平的下降被传导到v-ATPase的过程,更深化了我们对依赖于中间代谢产物及代谢酶来调节下游代谢信号通路的过程的认识。
在这里,醛缩酶既能够结合FBP从而感知FBP的水平,又能够催化FBP裂解成三碳糖。如果没有TRPV的参与,不断经历与底物FBP的结合-催化-不结合“周期”的醛缩酶就会引起v-ATPase和AMPK的活性的剧烈变化。TRPV的出现使得局部震荡式变化的FBP水平被“缓冲”成了一种相对稳定的、钙离子浓度的变化。具体地说,FBP足够高时,每一时刻总有一定数量(尽管不是全部)的醛缩酶结合着FBP,使其附近的TRPV保持着活力并进一步维持附近的钙离子浓度以维持v-ATPase的活力,阻止AMPK的“贸然”激活;只有当葡萄糖浓度真正下降,能够结合FBP的醛缩酶的比例真正地降低的时候,钙离子浓度才会因为TRPV的抑制而下降,允许TRPV进一步与v-ATPase结合并改变其构象,导致AMPK的激活。作者把上述TRPV的这一功能比喻成类似于电容器的”钙容器”(calcium capacitor),在时间和空间上确保了AMPK和其下游的重要途径的调控的精确性和可靠性。
鉴于由一种代谢产物通过一个中间步骤上的代谢酶调控下游生理功能的模式十分普遍——例如许多氨基酸转运蛋白就被发现能够在快速变构并转运氨基酸的同时,作为氨基酸水平的感受器在此时激活mTORC1并启动合成代谢途径(被称为“transceptor”)——这一工作对今后所有类似的研究都有重要的借鉴意义。

有意思的是,该工作其实来源于一次“失败的实验”。据林圣彩教授介绍,他们在2015年时,通过一种粗分的、含有溶酶体的“轻质膜泡(light organelles)”组分,在体外发现了FBP能够直接关闭溶酶体上AMPK的激活途径。然而,当他们尝试进一步纯化溶酶体,在一个更纯的体系里再一次重构上述的FBP的功能时,却怎么也无法得到同样的结果。在认真分析并排除了各种因素的影响之后,他们确定这是由于进一步的纯化过程使得轻质膜泡组分中的某些物质丢失所导致的。接下来,他们应用了各种对照,通过多轮的质谱分析以及长达两年的对所得结果的逐一验证,最终把目光锁定在TRPV家族上。尽管因为篇幅所限,在正式发表的文章中我们很遗憾地无法得见作者们的这些早期的探索和分析,但这一精彩而曲折的过程无不提醒我们,科学和探索是臻于至善、永无止境的。
该论文的共同第一作者为我院博士生李梦琪、张宸崧教授和博士生宗岳,林圣彩教授为通讯作者。该工作得到了国家自然科学基金、国家重点研发计划等项目的支持。
原文链接:https://doi.org/10.1016/j.cmet.2019.05.018
Bioart宣传文链接:https://mp.weixin.qq.com/s/fysvJqyz_OF6w54urEbbPA
(伟德BETVlCTOR1946)