检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2019年3月10号,细胞应激生物学国家重点实验室、伟德BETVlCTOR1946韩家淮课题组在Molecular & Cellular Proteomics杂志发表了题为“Quantification of dynamic protein interactions and phosphorylation in LPS signaling pathway by SWATH-MS”的研究论文,本文用SWATH-MS定量质谱技术系统性地研究了LPS信号通路中关键蛋白TRAF6、MyD88和NEMO复合物中的动态蛋白相互作用和磷酸化,揭示了在LPS刺激下Myddosome复合物中IRAK家族蛋白存在不同的招募速度。
LPS(脂多糖)是细菌细胞膜外膜一个主要的成分,其会被哺乳细胞的受体TLR4识别,并激活细胞内一系列信号通路,导致促炎细胞因子的释放。LPS/TLR4信号通路已经研究多年,其中大部分关键的作用蛋白已经被鉴定,但是仍有一些问题尚未解决,比如复合物的动态组装是如何实现以及复合物中关键作用蛋白相对比例是多少。为了解决这些问题,我们拟利用SWATH-MS技术去定量分析LPS信号通路中的关键蛋白复合物。为了纯化蛋白复合物,我们分别建立了Flag-knockin TRAF6、Flag-knockin MyD88和在NEMO敲除细胞中回补Flag-NEMO这三株RAW 264.7细胞系。我们利用LPS分别处理这三株细胞系十个时间点,然后用免疫亲和纯化(immunoprecipitation)的方法获得蛋白质复合物,并用SWATH-MS分析这些样品。
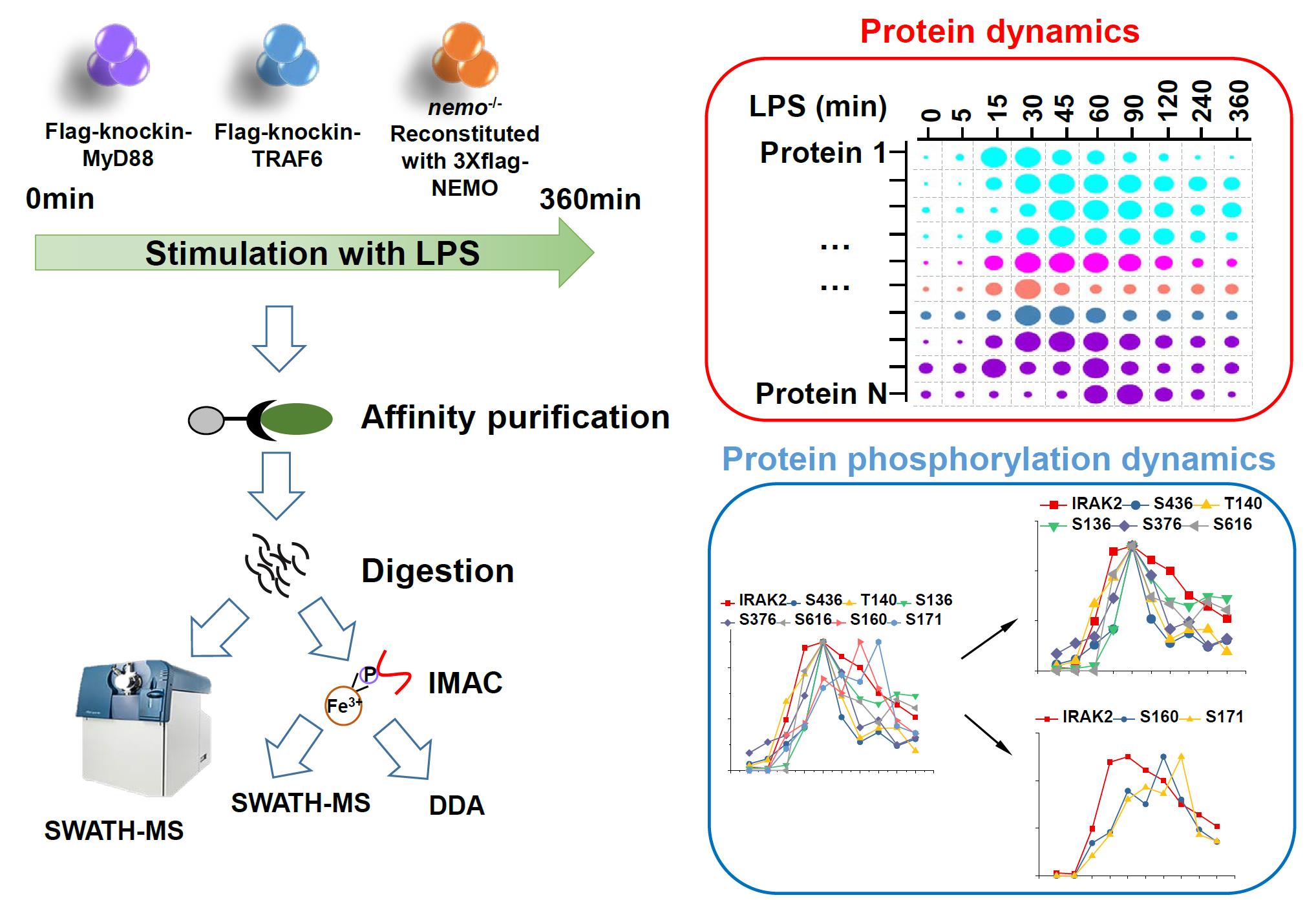
我们在30-40个IP样品中定量到2500-3000个蛋白,除此以外,我们在这些样品中鉴定到2000个左右的磷酸化位点。从这些定量数据中,我们成功地获得了所有的已知LPS信号通路中关键蛋白的动态变化信息。SWATH-MS结果显示,IRAK家族蛋白在招募到MyD88上时,有明显的时间先后之分,且与现有的报道不同。我们还分析了Myddosome中关键蛋白TIRAP和MyD88的比例,显示MyD88:TIRAP约为5:1,表明MyD88在复合物中以多聚的形式存在。此外,我们还鉴定到关键蛋白上的一系列磷酸化位点,发现NEMO上一个未报道的磷酸化位点,此位点的突变会影响NEMO激活NF-kB的能力。
综上,该研究系统地分析了LPS中蛋白复合物中关键蛋白动态变化和蛋白间的比例,且鉴定了一系列未报道的磷酸化位点,为后续的LPS信号通路研究提供了丰富的资源。
伟德国际官网登录入口博士后吴秀榕为文章的第一作者,通讯作者为韩家淮教授和钟传奇副教授。
原文链接:https://www.mcponline.org/content/early/2019/03/07/mcp.RA119.001380
(伟德BETVlCTOR1946)