检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
众所周知,肝脏是人体的一个重要的代谢器官,而它的大小相对于整个个体大小始终维持在一个合适的比例,即使在损伤或部分切除后,肝脏仍能通过一系列精细的再生调控过程恢复到正常大小。肝脏如何感知生长起始和停止是肝脏发育、再生以及癌症生物学中一个仍有待解决的基本科学问题。近年来研发现Hippo信号通路在从果蝇到哺乳动物个体的器官发育及大小调控中都起着至关重要的作用。在小鼠肝脏中特异性敲除或失活Hippo通路中的成员,都能促使肝脏过度生长直至癌变,然而具体何种外部因子在调控Hippo信号通路来维持肝脏大小稳态及抑制癌症发生一直是领域内未解决的问题。
胆汁酸代谢是肝脏的一个重要生理功能。肝细胞通过一系列的羟化反应将胆固醇转化为胆酸,并转运到胆囊中存储,当胆囊收缩时,胆酸随胆汁进入肠道,参与脂类的乳化等过程,在回肠被重吸收进入血液,经门静脉回到由肝脏转入胆囊,另有部分会通过粪便排出体外,这些构成了胆酸的肝肠循环。早期胚胎,肝肠循环回路未形成会造成肝脏胆汁淤积,可能是促进肝脏早期发育生长的重要因素。然而一些临床研究表明,成年肝脏胆酸的代谢异常会造成胆汁过度产生与淤积,或给小鼠喂食胆酸,都会导致肝脏增大及肿瘤的发生。

2019年2月7日,细胞应激生物学国家重点实验室、细胞信号网络协同创新中心、伟德BETVlCTOR1946的周大旺教授课题组在Developmental Cell杂志上发表了题为 FGF15 activates Hippo signaling to suppress bile acid metabolism and liver tumorigenesis的论文,揭示肝肠循环因子FGF15/19通过其肝脏受体FGFR4活化Hippo信号通路调节胆汁酸代谢,从而控制肝脏再生与尺寸大小。

图1.肝肠循环因子FGF15/19激活Hippo信号通路。
在这项研究中,研究人员首先通过小鼠连体共生实验,发现了Mst1/2(哺乳动物中Hippo的同源物)敲除小鼠血清中存在一种因子可以让野生型小鼠肝脏细胞中Hippo信号通路显著激活,随后通过生物化学及分子生物学手段证实, Mst1/2敲除小鼠血清FGF15(成纤维生长因子15,人的同源物为FGF19)水平显著上升且可以通过其受体FGFR4在野生型细胞中激活Mst1/2。
进一步的研究发现,在小鼠进食过程中,回肠细胞受到胆汁酸刺激分泌的FGF15通过血液循环进入肝脏后能激活受体FGFR4,活化的FGFR4募集并磷酸化NF2(一种神经纤维瘤病Ⅱ型基因编码的蛋白)第207位酪氨酸,被磷酸化的NF2通过竞争性结合Raf-Mst1/2复合物中的Raf(一种丝氨酸/苏氨酸蛋白激酶),解除Raf对Mst1/2的抑制,使其能够发挥激酶活性行使功能。
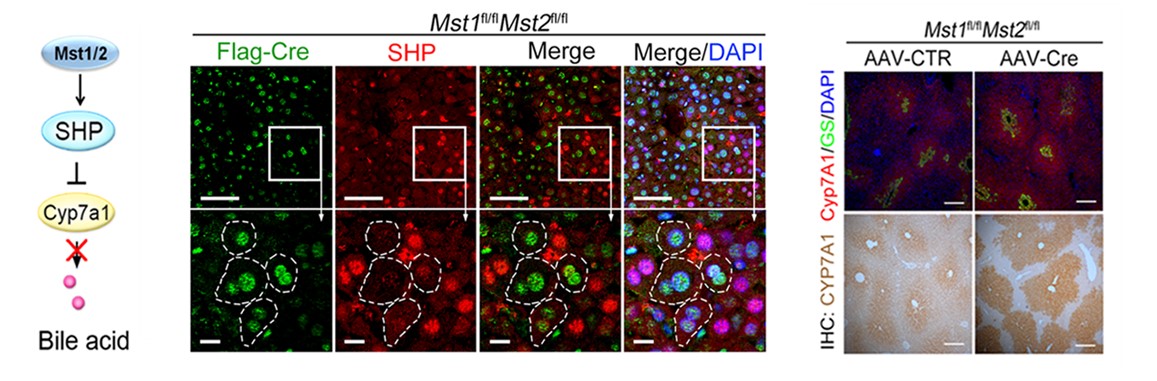
图2.激酶Mst1/2稳定核受体SHP从而抑制胆酸合成限速酶Cyp7a1表达,实现胆汁酸代谢调控。
研究中还发现,活化的Mst1/2能够通过支架蛋白WW45结合并磷酸化SHP第28位丝氨酸,抑制SHP的泛素化降解从而更稳定,肝细胞中上调的SHP通过抑制Cyp7a1(胆汁酸合成的限速酶)的转录达到抑制胆酸合成的目的。当Mst1/2缺失后,胆酸合成增加,大量积累的胆汁酸能够通过激活Hippo下游转录共活化因子Yap促进肝脏肿大及肝癌产生。消胆胺是一种FDA批准治疗胆汁淤积的药物,通过喂食消胆胺来降低体内胆汁酸水平可以有效缓解肝脏过度生长及肿瘤的形成。对肝癌临床样本分析发现,相当比例的肝癌患者存在着血清胆汁酸水平上调及肝细胞Hippo信号通路失活的现象,这与用小鼠模型进行的研究结果相符。

综上,该项研究发现了一个在生理上通过Hippo信号通路调控肝脏大小的因子FGF15, 解析了回肠在吸收胆酸时会感应胆酸的量并释放FGF15/19到血液中进行肝肠循环,然后在肝脏中FGF15-Hippo通路抑制胆酸合成和肿瘤形成的生理机制(上图),进一步揭示了Hippo信号通路失活导致胆汁酸合成代谢异常可能是人类肝癌的普遍现象和致病的重要因素,通过靶向控制FGF15-Hippo通路调控胆汁酸代谢,将会在临床应用中对控制肝脏生长及阻止肝癌产生有着重要的参考意义。
伟德BETVlCTOR1946博士生姬素渊、刘清许与博士后张世浩、陈青花及温州医科大学王聪副研究员为共同第一作者,通讯作者为周大旺教授。该工作还得到美国德州农工大学健康科学中心王奋教授课题组、伟德国际官网登录入口附属第一医院与中山医院等合作单位的大力支持。据悉,周大旺课题组及厦大生科院也在招聘博士后和助理教授,待遇优厚,请感兴趣并即将毕业的优秀博士生将个人简历发送到smxz@xmu.edu.cn。
原文链接:https://www.cell.com/developmental-cell/fulltext/S1534-5807(18)31117-1#
(伟德BETVlCTOR1946)