检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
近日,Cell Research(IF=15.393)在线发表了我院吴乔教授课题组的研究论文《Tom20 senses iron-activated ROS signaling to promote melanoma cell pyroptosis》,从机制上阐释了一条铁激活的ROS诱导黑色素瘤细胞焦亡的信号转导新通路。
活性氧(ROS)与肿瘤细胞死亡密切相关。ROS通过诱导DNA突变和基因组不稳定性或作为信号分子促进肿瘤发展,加速肿瘤细胞增殖、存活和转移。然而,过量的ROS增强细胞氧化应激,导致DNA、蛋白质或脂质的损伤,引起细胞凋亡或坏死。因此,通过化疗药物提高肿瘤细胞中的ROS水平已应用于临床癌症的治疗。
细胞中含有大量的ROS来源,包括铁依赖性的ROS激活。铁是几种产生ROS的酶的基本成分,如NADPH氧化酶(NOXs)、脂氧合酶(LOXs)、细胞色素P450(CYP)酶和线粒体电子传递链亚基。细胞中不稳定的铁池通过Fenton反应直接催化ROS生成。在大多数细胞中,过量的胞内铁可储存在铁蛋白中,由此被隔离而不参与ROS生成反应。铁蛋白包括两个亚基,即铁蛋白重链(FTH)和铁蛋白轻链(FTL)。铁蛋白的破坏导致ROS的升高和细胞死亡,并呈现铁的依赖方式,包括凋亡、坏死和铁死亡。由于铁在氧化应激具有重要作用,靶向铁已成为潜在的癌症治疗手段。
细胞焦亡(pyroptosis)是近年发现并被证实的由Gasdermin家族蛋白介导的一种新的程序性细胞坏死。目前已报道的机制有:活化的caspase-1/4/5/11切割GSDMD蛋白或者活化的caspase-3切割GSDME蛋白,使其产生具有打孔活性的N端片段,结果导致细胞渗透压变化,细胞不断胀大直至细胞膜破裂、内容物释放,发生焦亡。邵峰课题组发现,焦亡可能是传统抗肿瘤药物副作用(炎症反应)的来源之一。因此,焦亡是否能够成为治疗肿瘤的手段还需要进一步的研究。
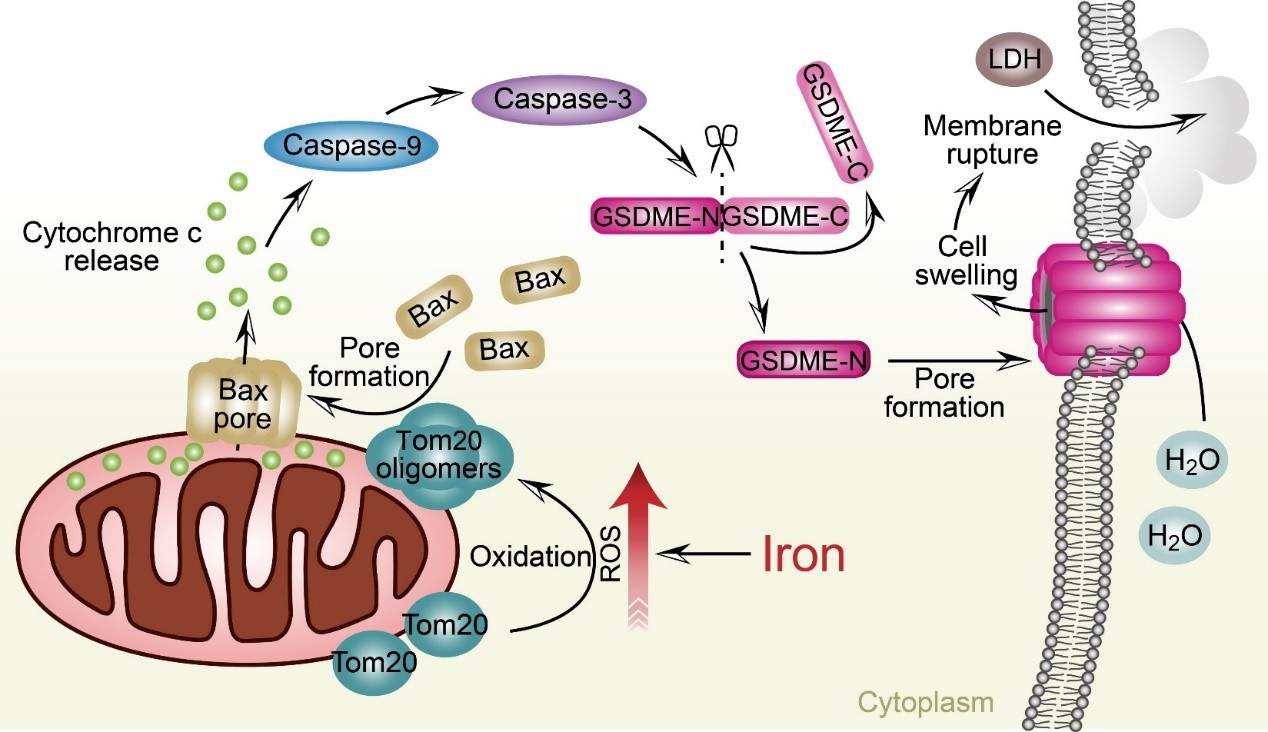
在研究铁代谢过程中,吴乔课题组意外发现在黑色素瘤细胞中铁参与细胞焦亡的诱导过程。CCCP是线粒体损伤剂。当内源性铁蛋白被破坏时,胞内游离铁增加,CCCP通过焦亡方式特异性诱导黑色素瘤细胞死亡。机制分析表明,铁离子和CCCP(或者其他ROS诱导药物)共同处理黑色素瘤细胞引起细胞ROS水平显著升高,线粒体外膜蛋白Tom20能够感知ROS,并被ROS氧化形成多聚体,由此促进线粒体聚集以及募集Bax蛋白到线粒体表面形成孔道,进而促进细胞色素C释放到胞浆,激活Caspase-9/Caspase-3;活化的Caspase-3切割并激活GSDME,导致细胞发生焦亡并释放LDH。机制研究展示了一条信号转导的新通路:ROS-Tom20-Caspase 3-GSDME。在小鼠模型中我们进一步验证了铁和ROS诱导药物联合使用可以通过激活GSDME来抑制黑色素瘤生长与转移。重要的是,这种抑制效果对小鼠的毒性极小。缺铁患者(2毫克铁/千克体重/天)使用的铁剂量补充就足以使这些临床药物的抗肿瘤作用最大化。黑色素瘤细胞表达较高水平的GSDME。由于黑色素瘤细胞通常对凋亡有抵抗力,这种与铁相关的焦亡诱导可能代表另一种治疗黑色素瘤的策略,对于黑色素瘤治疗及药物研发具有非常重要的意义。
该文共同第一作者为周波、张嘉媛、刘显硕和陈航姿。通讯作者为吴乔。
论文链接:https://www.nature.com/articles/s41422-018-0090-y
(伟德BETVlCTOR1946)