检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
近日,我院林圣彩教授和林舒勇副教授研究团队在《Cell Metabolism》杂志上在线发表了题为“AIDA Selectively Mediates Downregulation of Fat Synthesis Enzymes by ERAD to Retard Intestinal Fat Absorption and Prevent Obesity”的研究论文。该文已于4月3日以封面文章在《Cell Metabolism》上正式发表。该工作揭示了名为AIDA的蛋白质介导的内质网降解途径通过降解脂肪合成途径的代谢酶,限制膳食脂肪在肠道的吸收这一机体内在的抵御肥胖的机制。
人类遗传学家James V. Neel在1962年首次提出了“节俭基因”这一概念,认为现今人类导致包括肥胖症、糖尿病和高血压等代谢障碍的基因是因为生理系统为了适应远古环境食物富足和食物缺乏的周期性改变而筛选出的,可以让远古人类在食物富足的短暂时期中快速增肥,以应对随时将到来的食物缺乏时期。这类基因在当时环境下有很大的优越性,但对于当今食物富足的社会则截然相反。Neel用该节俭基因理论来解释为什么导致糖尿病的基因没有被自然选择淘汰出人类的基因库。那么,是否也会存在与这类“节俭基因”相反的“浪费基因”,在面对充足营养的时候主动限制营养的摄取以防止机体过度肥胖呢?该工作所研究的Aida就很可能是这样一种“浪费基因”。
AIDA是该团队首先鉴定和命名的蛋白,是调节体轴因子AXIN1的相互作用蛋白质。该团队与清华大学孟安明院士合作鉴定其在体轴发育的作用,相关工作在2007年发表于《Cell-细胞》子刊《Developmental Cell》杂志。为了研究AIDA蛋白在哺乳动物中的功能,该团队构建了Aida基因敲除小鼠,发现Aida敲除小鼠体重和体脂水平均明显高于野生型小鼠。通过对这株小鼠的代谢表型的全面分析,他们在鉴定AIDA蛋白的十年之后发现,AIDA的缺失会使膳食脂肪在小鼠肠道的吸收效率大大增加。
膳食脂肪进入体内后,首先在小肠里水解成脂肪酸和单酰甘油,被小肠上皮细胞摄入,在小肠上皮细胞中又重新合成脂肪,形成脂蛋白并从小肠上皮细胞分泌,而进入淋巴循环并通过血管输送到全身被各个器官利用或储存。而AIDA缺失小鼠中增高的脂肪吸收效率就来源于肠道中脂肪合成途径的数个合成酶的蛋白质水平的上调,促进脂肪酸重酯化减少细胞内的脂肪酸的含量,增加进一步从小肠里吸收脂肪酸。脂肪合成途径的代谢酶大多都定位于内质网。该团队通过机制的研究发现,AIDA缺失导致一种原先认为只调控内质网里的蛋白质质量和数量的途径——内质网降解途径(ERAD)无法降解这些脂肪合成酶,导致其蛋白水平上升。内质网降解途径的抑制剂处理的野生型小鼠的餐后血脂会上升到跟未处理的Aida敲除小鼠相同的水平,而该抑制剂对Aida敲除小鼠则没有作用,这表明Aida敲除和ERAD失效对于餐后血脂有完全一致的效果。在肠道特异性敲除Aida的小鼠中,肠细胞脂肪吸收的速率和血液中脂肪含量的上升速率等表型跟上述全身敲除小鼠非常类似,也表明了肠道中的AIDA在脂肪吸收效率的调控上至关重要。
有趣的是,AIDA与威尔第的著名歌剧《Aida》的女主角同名,而AIDA蛋白与ERAD途径密切配合以抵御肥胖也正如剧中女主角Aida和埃及将军Radames的至死不渝的爱情一般。这个浪漫的构思也被借用到该期杂志封面的设计,即以古埃及壁画风格刻画了Aida和Radames携手,击溃代表脂肪合成途径的代谢酶的敌兵,来抵抗以古埃及文字风格刻画的各种食物的诱惑。
该研究不仅发现了AIDA蛋白在哺乳动物中作为“浪费基因”的生理功能,揭示了内质网降解途径在膳食脂肪吸收过程中的重要功能,还首次提供了肠道脂肪吸收效率的上升会导致肥胖发生的实例。该论文的共同第一作者为博士生罗辉和姜鸣,林圣彩教授和林舒勇副教授则为共同通讯作者。该工作得到了国家重点基础研发计划、973计划、国家自然科学基金和伟德国际官网登录入口校长基金等支持。
文章链接:http://www.cell.com/cell-metabolism/fulltext/S1550-4131(18)30132-3
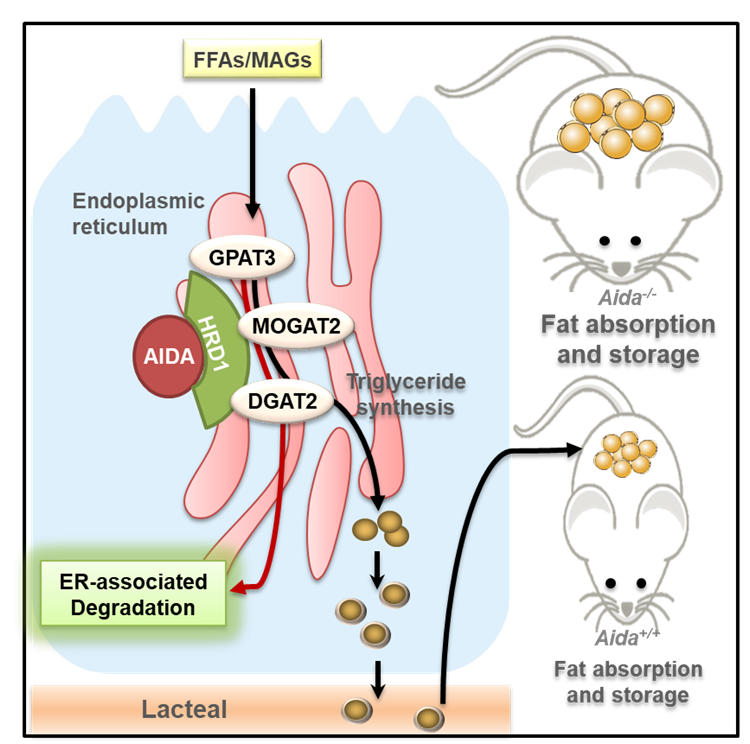
图. AIDA介导的内质网降解途径通过抑制膳食脂肪吸收而抵御肥胖模式图
(伟德BETVlCTOR1946)