检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox

5月8日,细胞信号网络协同创新中心、细胞应激生物学国家重点实验室、伟德BETVlCTOR1946周大旺教授和陈兰芬教授研究团队在癌症研究领域顶级学术期刊《Cancer Cell》上发表题为“Hippo Signaling Suppresses Cell Ploidy and Tumorigenesis through Skp2”的研究论文。该团队发现了Hippo信号通路在限制肝脏细胞的染色体由两倍体向多倍/非整倍体转变过程中起关键作用,该机制异常将导致基因组不稳定继而诱发肝癌的发生发展。
大多数真核生物的体细胞是二倍体,即仅含有两组染色体,分别遗传自父本和母本。而一些特定组织如心脏、肝脏等就含有多倍体细胞,特别是肝脏组织含有较高比例的四、八倍体等多倍体细胞。肝脏是人体的重要解毒器官,同时酒精、肝炎病毒等毒性物质或毒性代谢物容易诱发肝细胞的基因突变,多倍体被认为有利于提供代偿性的正常基因来维持肝脏稳态。多倍体细胞通常会停滞在细胞周期的间期——G1期,这些细胞很少进行细胞分裂增殖,并最终走向细胞衰老死亡。然而肝脏受损后,多倍体细胞将会受胁迫进行增殖,再生修复受损的肝组织。这些多倍体细胞分裂将导致三、五、七倍体等非整倍体的产生,也就是丢失匹配的染色体或染色片段,从而造成原癌基因的扩增或抑癌基因的丢失,引起基因组不稳定性和肿瘤的发生发展。因此研究机体调控多倍体细胞产生及多倍体细胞进行细胞分裂的调控机理对于理解肝癌的发病机理和肝癌的治疗至关重要。
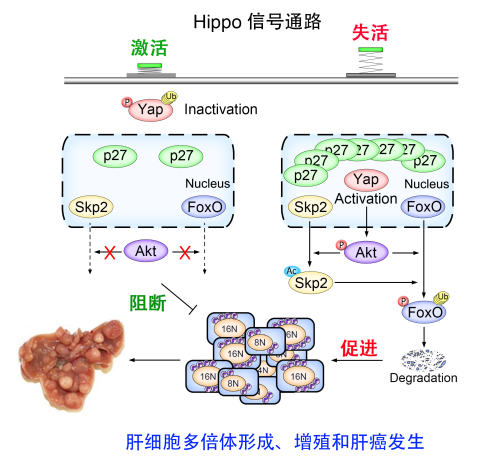
Hippo信号通路在调节组织成体干细胞的分化和增殖,调控器官再生与尺寸大小中具有重要作用。周大旺教授团队在先前研究获得靶向Hippo信号通路核心成员MST激酶的特异性小分子抑制剂,该抑制剂可以在体内有效促进损伤组织的修复与再生,该研究成果发表在《Science Translational Medicine》上,抑制剂专利已成功转让。另一方面,如果Hippo基因缺失则会造成组织持续性的再生,肝脏尺寸不断增大,最终导致肝细胞癌和胆管癌的产生。美国癌症基因组图谱TCGA大数据分析发现10-20%的肝癌样本中Hippo信号通路中的激酶发生缺失,10%的肝癌样本中Hippo下游的原癌基因YAP所在染色体片段发生扩增,因此该通路异常与肝癌发生密切相关。在这项研究中,周大旺研究组通过对Hippo信号通路重要成员(WW45,Mst1/2, Lats1/2)肝脏特异性敲除和过表达Hippo信号通路下游靶基因YAP的小鼠肝细胞进行流式分析发现,在肝脏中Hippo信号通路缺失会导致多倍/异倍体细胞比例显著增加,这些细胞进一步发生不正常的分裂造成基因组不稳定性。尽管Hippo信号通路缺失引起多倍体关键负调控分子P53表达水平的明显上调,但并不能阻断这一现象的发生。
深入研究发现, Hippo信号通路下游效应分子YAP通过AKT-SKP2信号促进二倍体细胞向多倍体转化及多倍体细胞的生长增殖。YAP可以强烈诱导乙酰转移酶P300对E3泛素连接酶SKP2的乙酰化,后者的乙酰化形式在细胞质中定位,造成其核内底物周期蛋白依赖性激酶抑制蛋白P27在核内大量累积,导致细胞有丝分裂阻滞并成为多倍体。另一方面,胞质中的SKP2大量降解促凋亡因子FoxO1/3,使多倍体细胞持续分裂,基因组不稳定,最终导致肿瘤发生。对人类肝癌样品的分析验证了以上结论,YAP的激活与SKP2乙酰化增强及FoxO1的下调有显著的相关性,并且YAP的入核与SKP2的出核也同时与肿瘤发展程度和不良预后成正相关。
本项研究阐明了Hippo缺失及YAP激活促进多倍体细胞产生及增殖作为肝癌发生发展中的一个重要机制,为肝癌诊疗提供了新的策略。该论文的主要工作由博士生张世浩、陈青花、刘清许、李玉席和孙秀峰等学生共同承担,并与中科院生化细胞所、美国爱因斯坦医学院、日本九州大学等单位合作完成,通讯作者为陈兰芬教授和周大旺教授。该研究工作获得了国家自然科学基金委、国家重点基础研究发展计划(973)项目、中央高校基本科研基金的资助。
周大旺教授研究团队长期从事Hippo信号通路研究,通过基因敲除、敲入或转基因手段揭示了Hippo信号通路在组织再生重塑、肿瘤发生及免疫疾病中的起重要作用。近五年以通讯作者在《Cancer Cell》、《Nature Immunology》、《Science Translational Medicine》等国际重要期刊上发表多篇论文。
论文链接:http://www.cell.com/cancer-cell/fulltext/S1535-6108(17)30159-9
(伟德BETVlCTOR1946)