检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
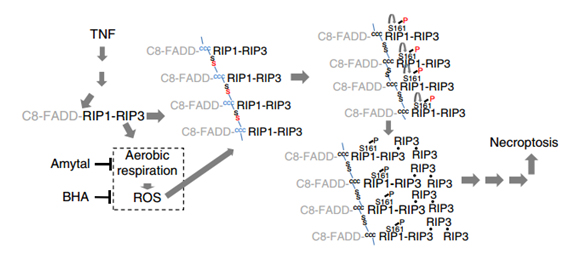
2017年2月8日,国际知名学术刊物Nature Communications在线发表了韩家淮教授课题组的最新研究成果“RIP1 Autophosphorylation Is Promoted by Mitochondrial ROS and Is Essential for RIP3 Recruitment into Necrosome”,揭示了活性氧簇(ROS)通过直接特异地氧化受体相互作用丝氨酸/苏氨酸激酶1(RIP1)上的三个关键的半胱氨酸,进而特异地增强RIP1在S161上的自磷酸化,从而促进坏死小体的形成和程序性细胞坏死的发生。
程序性细胞坏死是一种高度受调控的细胞死亡方式,它参与到机体的多种病理过程中,因而受到学术界的广泛关注,比如细菌和病毒感染,或者动脉粥样硬化等无菌损伤导致的炎性病变。程序性细胞坏死在生理病理上的重要性决定了它在调控上的复杂性。因此,尽管关于它的机制研究被频繁报道,仍然有许多重要的科学问题尚未解决。其中,线粒体ROS在程序性细胞坏死中的作用和分子机制,是近20年内该领域一个长期存在且有争议的问题。另一个长期存在的问题是,RIP1作为程序性坏死通路上的核心蛋白,它的激酶活性是行使功能所必需的,但是RIP1的激酶活性在程序性细胞坏死中起了什么样的作用仍然未知。
韩家淮教授课题组的这项研究表明,这两个科学问题是相关联的。研究人员利用质谱技术首次证实,RIP1通过其上的三个关键的半胱氨酸(C257,C268和C586)直接接受ROS的氧化调控,进而增强激酶活性,发生第161位丝氨酸(S161)的自磷酸化。他们证实了RIP1的激酶活性在程序性细胞坏死中的主要功能是自磷酸化S161,且S161就是人们长期寻找的RIP1上与坏死相关的功能性磷酸化位点。坏死小体的形成是程序性细胞坏死发生的必要复合物,而S161的磷酸化是RIP1有效募集RIP3形成有功能的坏死小体所必需的。由于ROS的产生依赖于坏死小体里的RIP3的功能,因此ROS介导了程序性坏死通路里的正反馈调控。
韩家淮教授课题组的研究阐明了ROS促进程序性细胞坏死的分子机制,回答了领域内长期存在的两个科学问题,对全面解析程序性坏死机制并协助疾病治疗具有重要意义。
张荧荧和苏晟为该论文的共同第一作者。该项研究得到了973计划和国家自然科学基金委员会重点和重大研究计划项目的经费支持。
论文原文链接:http://www.nature.com/articles/ncomms14329
论文的模式图如下:
(伟德BETVlCTOR1946)