检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2022年6月7日,细胞应激生物学国家重点实验室、伟德BETVlCTOR1946刘亮教授课题组在《Nature Communications》杂志在线发表题为“Structural basis for MTA1c-mediated DNA N6-adenine methylation”的研究论文。该研究工作揭示了嗜热四膜虫来源的DNA甲基转移酶复合体MTA1c催化DNA 6mA甲基化的分子机制。

DNA甲基化在生物生长发育乃至人类健康和疾病发生中具有举足轻重的作用。2015起,多个课题组在研究中发现,真核生物的基因组中存在有很低峰度的DNA 6mA甲基化修饰,研究发现其在基因表达调控和人类疾病中发挥了重要作用,随后,越来越多的研究开始聚焦DNA 6mA甲基化的研究。由于6mA修饰在真核生物基因组中含量很低,负责该修饰的甲基转移酶的探索也成为了本领域发展的关键突破口。
研究发现,相较于多细胞真核生物而言,四膜虫基因组6mA修饰含量很高,且主要集中在转录起始区域。2019年,哥伦比亚大学Laura F. Landweber的研究团队在纤毛虫中确定了首个真核生物的DNA 6mA甲基转移酶复合体—MTA1c。该复合体由MTA1、MTA9、p1、p2四个蛋白组成。研究发现,MTA1c可以特异性甲基化双链DNA中的ApT二核苷酸,且催化位点主要位于核小体间隔的中间区域。但是,MTA1c是如何特异性识别底物以及该复合物是如何介导6mA催化的分子机制并不清楚。
为揭示真核生物DNA 6mA甲基化的功能和调控机制,本研究从嗜热四膜虫MTA1c复合体入手,结合生物化学与分子生物学和结构生物学的研究手段和技术,通过解析多个MTA1c相关复合物的结构发现:MTA1是MTA1c复合体的核心蛋白和催化亚基,可以分别与MTA9、p1、p2相互作用,从而驱动MTA1c四元复合体的组装。在不与p2结合时,MTA1处于自抑制构象,不与甲基供体—SAM结合;在与p2结合后,MTA1的自抑制构象解除。本研究首次发现,p2可以通过变构调节MTA1的SAM结合口袋来激活MTA1c复合物的甲基转移酶活性。这一机制,完全不同于以往报道的DNA/RNA甲基转移酶的催化机制。
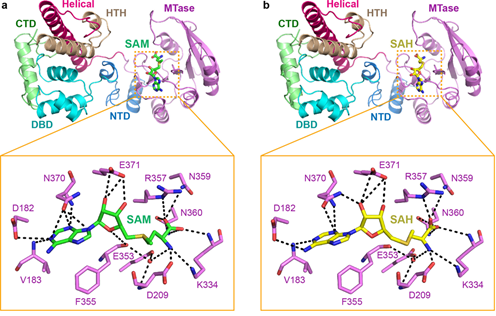
MTA1c识别SAM和SAH的结构基础
另外,本研究发现,MTA1、MTA9、p1和p2通过结构组装,可形成一个特殊的DNA结合通道,且四个蛋白均参与了对底物DNA的特异性的识别,但最终只由MTA1来催化甲基从SAM向DNA腺嘌呤N6位的转移。
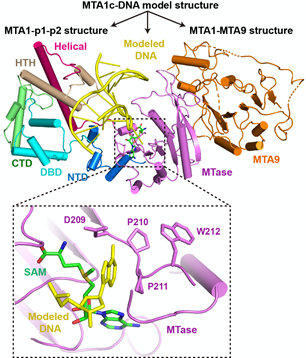
MTA1c识别底物DNA的结构模型
本工作首次解析了嗜热四膜虫DNA 6mA甲基转移酶复合体的原子结构,系统研究了MTA1c催化真核生物DNA 6mA甲基化的分子机制。该工作丰富了真核生物DNA 6mA甲基化调控以及6mA修饰的认知,对于研究生物体DNA甲基化酶的功能和修饰具有重要的意义,同时为研究DNA 6mA甲基化参与真核生物基因表达调控等多个生命过程提供了重要的结构基础。
刘亮课题组助理教授陈霁云、2017级博士研究生胡荣、2020级硕士研究生陈莹、2020级硕士研究生林晓峰为本文的共同第一作者。刘亮教授为本论文的通讯作者。该研究得到了中国科协青年人才托举工程、国家自然科学基金和伟德国际官网登录入口高层次人才科研启动经费的资助。该工作还得到了伟德国际官网登录入口海洋与地球学院张文静教授、伟德国际官网登录入口生物医学仪器共享平台陈俊杰、田莹普等各位老师的大力支持。
原文链接:https://www.nature.com/articles/s41467-022-31060-6
(图/文 刘亮课题组)