检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
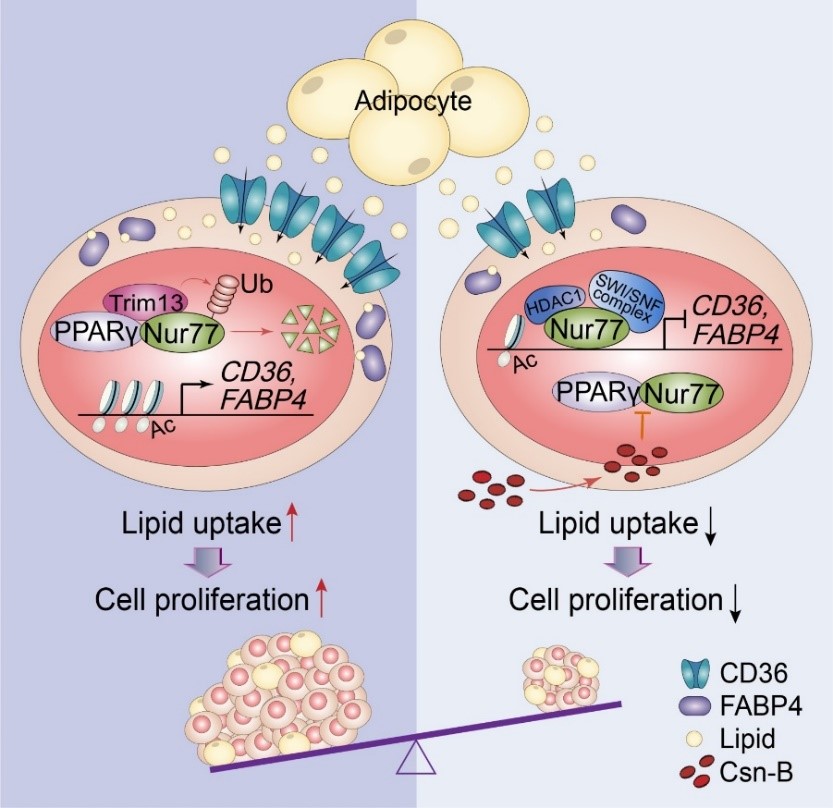
近日,吴乔教授课题组与林天伟教授课题组合作在《PNAS》在线发表了题为《Blocking PPARγinteraction facilitates Nur77 interdiction of fatty acid uptake and suppresses breast cancer progression》的研究论文。该研究揭示了核受体Nur77作为转录因子,在乳腺癌中通过调控脂肪酸吸收和转运基因从而阻断细胞对外源脂肪酸的摄取,进而抑制乳腺癌细胞增殖的信号转导通路,同时也阐明了Nur77在乳腺癌的发生发展中被泛素蛋白酶体降解的机制,并提出了干预策略。
脂肪酸代谢是体内非常重要的代谢途径之一,对细胞稳态维持发挥重要的作用。肿瘤细胞以从头合成的方式产生自身所需的脂肪酸供细胞生长,但是这种方式所提供的脂肪酸对细胞来说并不经济,因此肿瘤细胞更喜欢直接从微环境中汲取脂类物质来满足自身增殖旺盛的需求。因此,靶向脂肪酸摄取和转运成为了一个有吸引力的治疗策略。
在这项研究中,吴乔课题组首先在PyMT自发性乳腺癌小鼠模型和化学试剂(MPA-DMBA)诱导的小鼠模型中证明了敲除Nur77可促进小鼠乳腺肿瘤发展,而在敲除Nur77的PyMT小鼠乳腺组织中重新特异性表达Nur77后则抑制乳腺肿瘤进展。信号转导通路研究发现,Nur77通过招募SWI/SNF复合体抑制脂肪酸吸收相关基因CD36和FABP4的表达,阻断乳腺癌细胞对外源脂肪酸的吸收,从而抑制肿瘤细胞的增殖。但是乳腺癌细胞中的另外一个核受体PPARγ通过募集泛素连接酶Trim13靶向底物蛋白Nur77,诱导Nur77的泛素化降解。因此,阻断PPARγ与Nur77的相互结合有望保证Nur77抑制乳腺癌细胞生长的功能发挥。通过大量的化合物筛选分析,吴乔课题组发现了小分子化合物cytosporone B (Csn-B)能够靶向Nur77的配体结合域(LBD),阻断PPARγ与Nur77之间的结合,从而加强Nur77抑制乳腺癌进程。在此基础上,林天伟课题组解析了Nur77-LBD与Csn-B的共晶结构以及Nur77-LBD与PPARγ分子对接模型,在分子水平上进一步明确了小分子化合物Csn-B结合Nur77的关键作用位点,同时证明了Csn-B增强Nur77同源二聚体的形成,通过空间位阻阻断了PPARγ与Nur77的结合,由此拮抗PPARγ诱导的Nur77泛素化降解,保证Nur77抑制外源脂肪酸摄取最终抑制乳腺癌的发展进程。
总之,该研究不仅揭示了Nur77通过调节脂质代谢途径抑制乳腺癌进展的作用机制,而且确定了Nur77特异性激动剂Csn-B是一种有效的治疗乳腺癌的小分子化合物。该论文的共同第一作者为杨鹏博、侯佩佩、刘馥源、洪文斌、陈航姿,通讯作者为吴乔教授和林天伟教授。该工作得到了国家基金委重大研究计划的重点项目支持。
文章链接:https://www.pnas.org/content/early/2020/10/20/2002997117.abstract?etoc
(图/文 吴乔课题组)