检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
坏死样凋亡(Necroptosis)是一种由RIP3-MLKL介导的程序性细胞坏死(programmed necrosis),它可以被Death receptors, TLR receptors, Interferon receptor以及病原体感染等多种刺激所诱发。坏死样凋亡伴随着细胞内容物的释放,它在TNF介导的系统性炎症反应综合征,缺血再灌注损伤,神经退行性疾病,胰腺炎,肠炎等多种病理过程,以及在T细胞稳态维持,胚胎发育等多种生理过程中,都扮演重要角色(1)。由于坏死样凋亡的炎症属性,它的诱发受到了极其严密的调控,其中最为重要的调控执行者是caspase-8。
体内和体外研究的大量证据表明,caspase-8通过剪切RIP1/RIP3破坏坏死小体(necrosome)的稳定性,从而阻滞坏死样凋亡的诱发(2)。Caspase-8基因敲除的小鼠胚胎会自发产生RIP3-MLKL介导的坏死样凋亡,导致胚胎死亡(2, 3);而大多数细胞系都需要抑制caspase-8活性,如额外添加caspase抑制剂如zVAD,才能发生坏死样凋亡。然而,在caspase-8活性没有被人为破坏或抑制的情况下,体内多种生理和病理过程中都检测到了坏死样凋亡的发生(4);也有少数的几种细胞系如L929(5),NIH3T3-N line(6), oligodendrocyte(7)等都可以在不需要额外加入zVAD的条件下发生坏死样凋亡。这些现象表明,在体内必然存在一种内源性机制可以克服caspase-8对坏死样凋亡的抑制作用。这一未知但关键的机制,是细胞死亡研究领域内重要的科学问题。
2020年9月25日,细胞应激生物学国家重点实验室,伟德BETVlCTOR1946韩家淮课题组和莫玮课题组合作在Molecular Cell杂志上发表题为“A Non-canonical PDK1-RSK Signal Diminishes Pro-Caspase-8-Mediated Necroptosis Blockade”的研究文章,报道了非经典的PDK1-RSK信号解除caspase-8对坏死样凋亡的抑制作用的内源性机制。

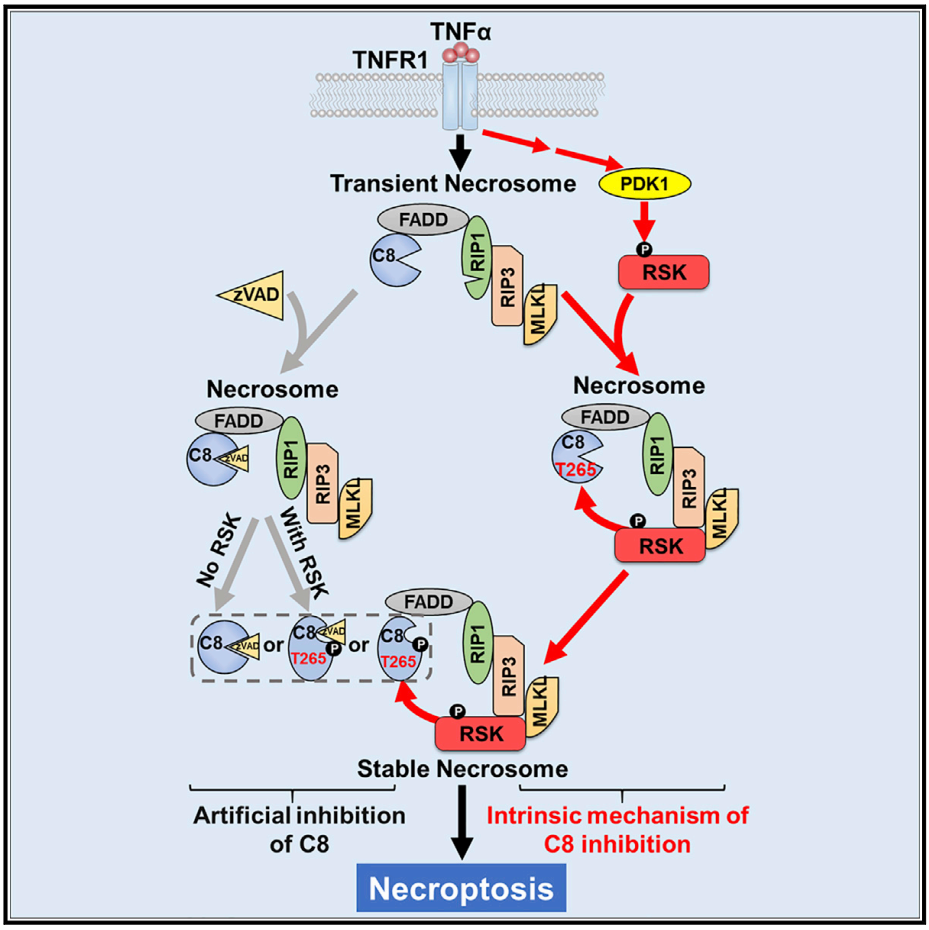
Caspase的活性可以被磷酸化等多种翻译后修饰所调控。作者通过质谱鉴定并确认caspase-8 Thr265磷酸化后可以完全破坏其活性。结构模拟的结果表明,Thr265位于caspase-8的底物结合口袋上,该位点的磷酸化会直接破坏这个底物结合口袋的构象,从而抑制caspase-8的活性。作者在多种发生坏死样凋亡的细胞系统中,以及在发生坏死样凋亡的组织中确认caspase-8 Thr265磷酸化的特异性。Caspase-8 Thr265磷酸化发生在坏死小体复合物上,可以替代caspase-8的抑制剂zVAD,稳定坏死小体。Caspase-8 Thr265不受调控的磷酸化可以完全破坏其对坏死样凋亡的抑制功能,导致坏死样凋亡的爆发。组成性caspase-8 Thr265磷酸化突变小鼠T265E在胚胎期发生死亡,死因与caspase-8酶活缺失小鼠或caspase-8基因敲除小鼠完全一致——坏死样凋亡在胚胎发育时期不可控的大爆发。
介导caspase-8 Thr265磷酸化的上游激酶是什么?作者发现坏死小体中的RIP1/3以及MLKL都不直接承担此责;坏死小体通过招募RSK (p90 ribosomal S6 kinase) 实现对caspase-8 Thr265的磷酸化,解除caspase-8对坏死小体的切割活性;通过caspase-8检验点使得坏死样凋亡进程得以继续。缺失RSK的细胞中坏死小体极不稳定,其TNF诱导的坏死样凋亡信号的响应显著减弱;而过表达RSK的细胞无需额外抑制caspase-8 (caspase抑制剂zVAD)即可发生TNF诱导的坏死样凋亡,表明RSK一定程度上可以替代zVAD促进坏死样凋亡的效果。
RSK包含两个激酶结构域,N端激酶结构域和C端激酶结构域。在经典模型中,RSK是通过ERK,RSK的C端激酶结构域和PDK1的依次级联磷酸化实现激活的(8)。但在TNF诱导坏死样凋亡过程中,RSK对caspase-8的磷酸化不依赖于RSK的C端激酶结构域以及ERK;RSK的N端激酶结构域被PDK1通过一种全新的非经典的方式激活,并执行磷酸化caspase-8的功能。RSK的N端激酶结构域抑制剂BI-D1870显著减弱小鼠组织中的坏死样凋亡,极大地缓解由坏死样凋亡造成的组织损伤和小鼠死亡。这为治疗坏死样凋亡相关疾病提供了一个全新的可能靶点。
综上所述,该研究揭示了非经典的PDK1-RSK信号轴是细胞克服caspase-8对坏死样凋亡检验点的内在机制;通过磷酸化抑制caspase-8的活性,从而稳定坏死小体,促进坏死样凋亡的发生。
韩家淮课题组博士后杨章华、博士生何鹏以及伟德国际官网登录入口药学院助理教授吴晓男是该论文的第一作者;韩家淮院士和莫玮教授为该论文的共同通讯作者。
文章链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(20)30612-2
Reference:
1. Han, J., Zhong, C. Q. & Zhang, D. W. Programmed necrosis: backup to and competitor with apoptosis in the immune system.Nat Immunol12, 1143-1149, doi:10.1038/ni.2159 (2011).
2. Kaiser, W. J.et al.RIP3 mediates the embryonic lethality of caspase-8-deficient mice.Nature471, 368-372, doi:10.1038/nature09857 (2011).
3. Oberst, A.et al.Catalytic activity of the caspase-8-FLIP(L) complex inhibits RIPK3-dependent necrosis.Nature471, 363-367, doi:10.1038/nature09852 (2011).
4. Jouan-Lanhouet, S.et al.Necroptosis, in vivo detection in experimental disease models.Semin Cell Dev Biol35, 2-13, doi:10.1016/j.semcdb.2014.08.010 (2014).
5. Vercammen, D., Vandenabeele, P., Beyaert, R., Declercq, W. & Fiers, W. Tumour necrosis factor-induced necrosis versus anti-Fas-induced apoptosis in L929 cells.Cytokine9, 801-808, doi:10.1006/cyto.1997.0252 (1997).
6. Zhang, D. W.et al.RIP3, an energy metabolism regulator that switches TNF-induced cell death from apoptosis to necrosis.Science325, 332-336, doi:10.1126/science.1172308 (2009).
7. Ofengeim, D.et al.Activation of necroptosis in multiple sclerosis.Cell Rep10, 1836-1849, doi:10.1016/j.celrep.2015.02.051 (2015).
8. Houles, T. & Roux, P. P. Defining the role of the RSK isoforms in cancer.Semin Cancer Biol48, 53-61, doi:10.1016/j.semcancer.2017.04.016 (2018).
(图/文 韩家淮课题组)